远视性弱视矫正的远视力和近视力
这最新版美国弱视临床眼科指南(PPP)提出,弱视治疗的第一步以及首选方法是单独进行光学矫正,其次是增加遮盖、药物、光学压抑治疗等。另外,指南提出视觉疗法、双眼疗法和中医针灸等可作为主要疗法无效时的替代疗法,但目前暂无足够的证据推荐[1]。
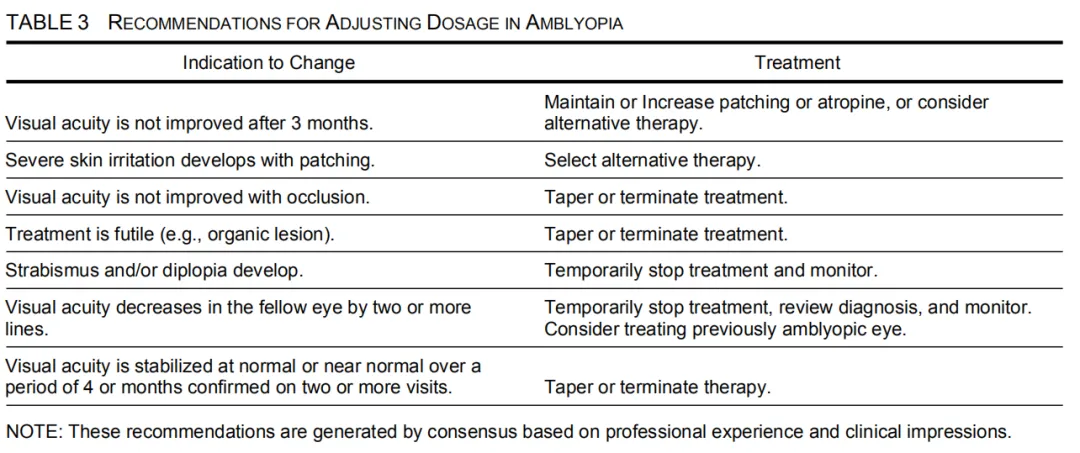
美国弱视PPP中关于调整弱视治疗方案的建议
目前在治疗和矫正儿童远视性弱视的时候,大家都很关心远视力,而忽略近距离(精细视觉)的双眼视觉。对于正常人,由于视功能已经发育成熟,远视力和近视力差异有限,所以追求远视力是可以被理解的。但对于视功能发育尚未完成的弱视儿童,近视力可能更重要。
婴幼儿的视力很差,出生6个月内,视网膜无法形成清晰的像。研究发现,儿童在3岁时候,裸眼视力平均只有0.5[2],儿童这种视觉特征其实是由儿童的人眼光学特性决定的。
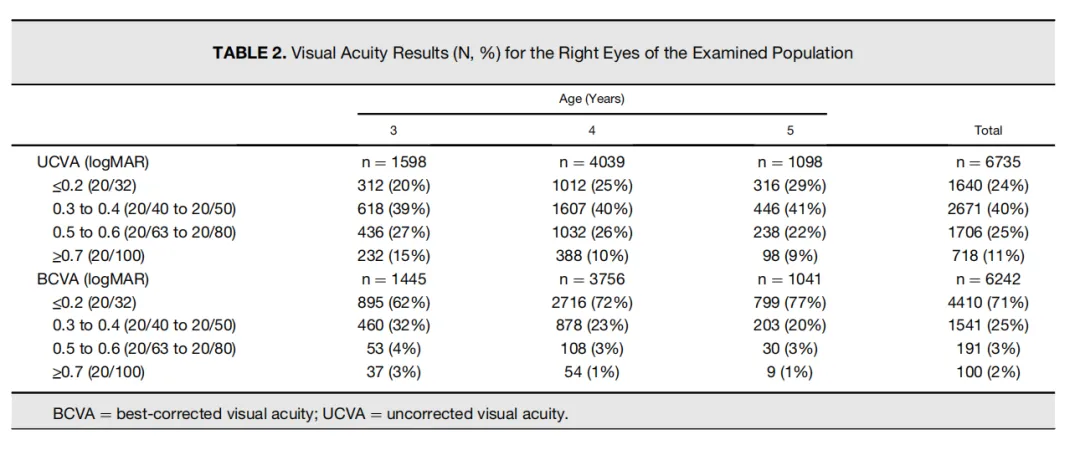
3~5岁儿童的视力情况
首先是眼轴,婴幼儿的眼球很小,眼轴很短[3],即便不考虑任何其他因素,短眼轴的人视觉能力都会比长眼轴差。一个光学系统的几何分辨率是由系统的最小分辨角决定的,如果眼轴为24mm,那么该眼就大约1弧分的最小分辨角(E字表上的1.0,在几何光学上的定义就是5米远距离1弧分的最小分辨角)。如果眼轴变短到12mm,那只剩2弧分的最小分辨角(E字表0.5)。不过这仅仅是为了简单表述,事实上要计算人眼节点位置才能确定最小分辨角,但眼轴变短情况下,最小分辨角的变化率肯定会更大,几何分辨率变差。
其次是晶状体,人眼晶状体的发育过程也是像差不断减少的过程。研究证明,由于晶状体皮质折射率小于核质,而皮质不断在周边生长,导致晶状体周边的屈光度不断减少,这种结构在光学上称为GRIN[4]。婴幼儿的晶状体大量核质,属于双凸透镜,屈光度30-40D[5-6],这种结构的像差会大,导致视网膜成像质量差!到12岁,正常人的晶状体屈光度减少到20D,同时周边已经形成大量皮质,形成显著的GRIN光学系统,导致晶状体的像差大幅度减少,视网膜成像质量大幅度提高。所以一个晶状体屈光度很大的人,无论是成年人还是儿童,无论是近视还是远视,无论是长眼轴和短眼轴,远场最佳视力都不会太好。
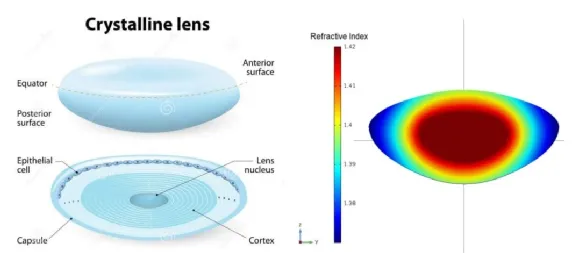
GRIN结构
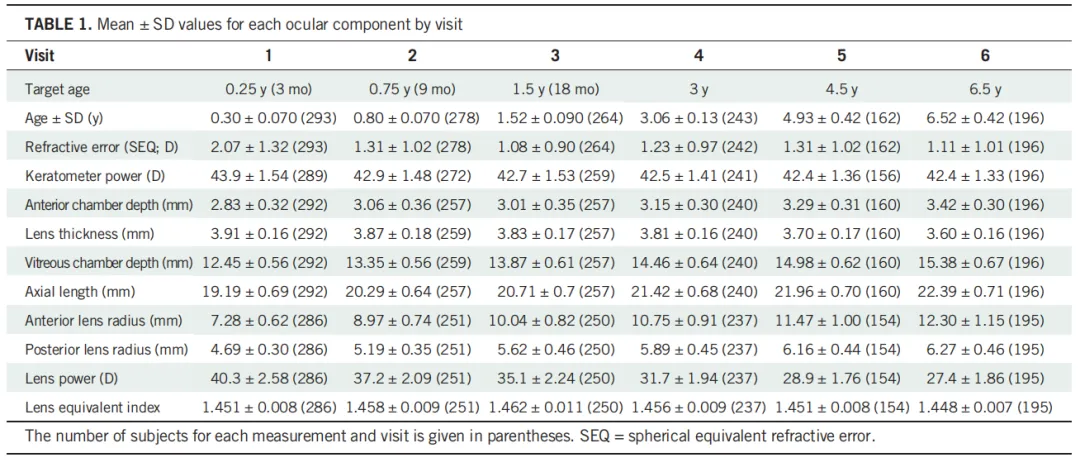
3周~6.5岁婴幼儿的眼部参数
然后是视锥细胞,研究证明,儿童的视锥细胞短小粗大。最新的研究发现,视锥细胞其实是一个类似光纤的波导体[7]。视锥细胞内段截面大,导致进入视锥细胞的截止角度变大,而视锥细胞长度变短,导致大入射角的光波无法通过波导效应消除掉。所以粗大短小的视锥细胞也注定婴儿的视网膜成像质量差。研究也证明,在发育过程中,人眼的视锥细胞会变得越来越长,越来越细[8],波导性能就大幅度提高,视网膜成像质量大幅度提高。视锥细胞从粗短变成细长不仅仅是波导的传播性能得到大幅度提高,还影响不同频率波长在视锥细胞的耦合效应,导致视网膜成像的物理分辨率变化[9-10]。
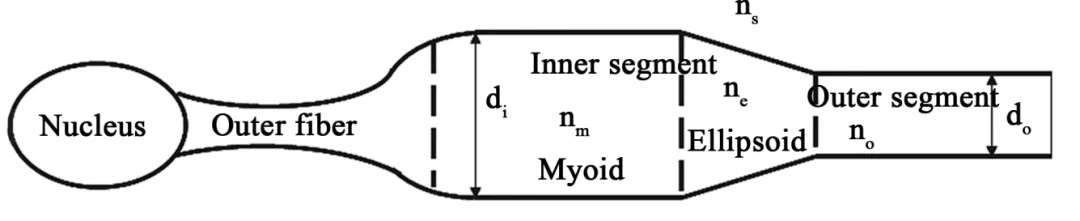
视锥细胞的光学模型
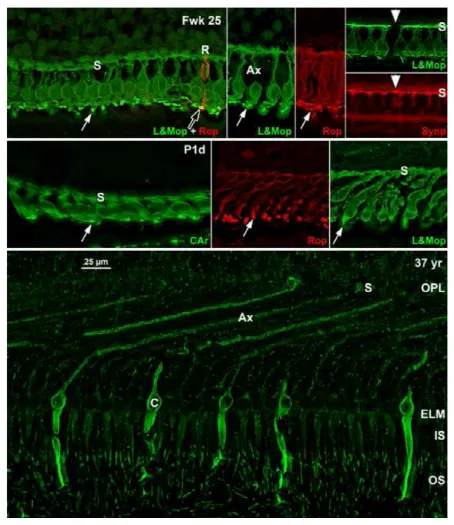
25周胚胎、出生1天和37岁成人的光感受器形态差异
综合上述三个方面,我们不难得出一个结论,眼轴短、晶状体屈光度大、视锥细胞粗短等生理学特性决定了远视性弱视儿童视网膜成像质量劣化[11]。这种劣化尤其表现在远视力上!治疗远视性弱视首先是要促进儿童眼球的发育,包括眼轴变长、晶状体皮质生长、视锥细胞变细长等等。而研究也证明良好的视觉质量可以促进眼球发育,如果远视力无法短时间提升,那么我们完全可以通过改善近视力促进弱视眼的发育,一旦眼球发育,远视力也会逐步提高。如果只强调远视力,而忽略近视力双眼视觉,最后会导致整个弱视治疗的失败。
从光学矫正角度,对于一个尚未成熟的人眼,提高远视力一般都会降低精细视觉能力。特别是片面强调弱视眼单眼的远视力提高,往往会导致精细视觉下的双眼视觉功能下降!因为在劣质光学系统中,提高几何分辨率的唯一办法就是加大视觉放大率,而这样做可能会导致单个视锥细胞的光量子流密度降低,导致视网膜物理分辨率下降,同时也会导致双眼视网膜不等像加剧!
参考文献
[1]Wallace D K , Repka M X , Lee K A , et al. Amblyopia Preferred Practice Pattern[J]. Ophthalmology, 2017, 125(1):P105-P142.
[2]Margines J B , Huang C , Young A , et al. Refractive Errors and Amblyopia Among Children Screened by the UCLA Preschool Vision Program in Los Angeles County[J]. American Journal of Ophthalmology, 2019, 210.
[3]Mutti D O , Mitchell G L , Jones L A , et al. Axial Growth and Changes in Lenticular and Corneal Power during Emmetropization in Infants[J]. Invest Ophthalmol Vis, 2005, 10(2):188-189.
[4]Augusteyn R C . On the growth and internal structure of the human lens[J]. Experimental Eye Research, 2010, 90(6):643-654.
[5]Wood I C J , Mutti D O , Zadnik K . Crystalline lens parameters in infancy[J]. Ophthalmic & Physiological Optics the Journal of the British College of Ophthalmic Opticians, 2010, 16(4):256-256.
[6]Mutti D O , Sinnott L T , Mitchell G L , et al. Ocular Component Development during Infancy and Early Childhood[J]. other, 2018, 95(11).
[7]梁安辉,蒙自明.用视锥的光纤耦合器理论解释色觉[J].科学通报,2016,61(26):2952-2959.
[8]Hendrickson A , Possin D , Vajzovic L , et al. Histologic Development of the Human Fovea From Midgestation to Maturity[J]. American Journal of Ophthalmology, 2012, 154(5):767-778.e2.
[9]Vohnsen, Brian. Photoreceptor waveguides and effective retinal image quality[J]. J Opt Soc Am A Opt Image Sci Vis, 2007, 24(3):597-607.Marcos S , Burns S A . Cone spacing and waveguide properties from cone directionality measurements[J]. Journal of the Optical Society of America A Optics Image Science & Vision, 1999, 16(5):995.
[10]Marcos S , Burns S A . Cone spacing and waveguide properties from cone directionality measurements[J]. Josaa/16/5/josaa Pdf, 1999, 16(5):995-0.
[11]Cass K , Tromans C . A biometric investigation of ocular components in amblyopia.[J]. Ophthalmic Physiol Opt, 2010, 28(5):429-440.






